9 0 7 9 9
论文已发表
注册即可获取德孚的最新动态
IF 收录期刊
- 2.6 Breast Cancer (Dove Med Press)
- 3.9 Clin Epidemiol
- 3.3 Cancer Manag Res
- 3.9 Infect Drug Resist
- 3.6 Clin Interv Aging
- 4.8 Drug Des Dev Ther
- 2.8 Int J Chronic Obstr
- 8.0 Int J Nanomed
- 2.3 Int J Women's Health
- 3.2 Neuropsych Dis Treat
- 4.0 OncoTargets Ther
- 2.2 Patient Prefer Adher
- 2.8 Ther Clin Risk Manag
- 2.7 J Pain Res
- 3.3 Diabet Metab Synd Ob
- 4.3 Psychol Res Behav Ma
- 3.4 Nat Sci Sleep
- 1.9 Pharmgenomics Pers Med
- 3.5 Risk Manag Healthc Policy
- 4.5 J Inflamm Res
- 2.3 Int J Gen Med
- 4.1 J Hepatocell Carcinoma
- 3.2 J Asthma Allergy
- 2.3 Clin Cosmet Investig Dermatol
- 3.3 J Multidiscip Healthc

重组外膜囊泡具有在小鼠 TC-1 移植瘤模型中激发 HPV16E7 特异性细胞免疫应答的能力
Authors Wang S, Huang W, Li K, Yao Y, Yang X, Bai H, Sun W, Liu C, Ma Y
Received 5 June 2017
Accepted for publication 11 August 2017
Published 12 September 2017 Volume 2017:12 Pages 6813—6825
DOI https://doi.org/10.2147/IJN.S143264
Checked for plagiarism Yes
Review by Single-blind
Peer reviewers approved by Dr Thiruganesh Ramasamy
Peer reviewer comments 2
Editor who approved publication: Professor Dongwoo Khang
目的:目前治疗性肿瘤疫苗在人类临床实验中的效果并不理想,开发新型抗原递送系统是一种潜在提高肿瘤疫苗效力的手段。本研究证明了重组细菌外膜囊泡(OMVs)可以作为一种新型疫苗载体来呈递肿瘤抗原,从而激发抗肿瘤免疫应答。
材料与方法:(1)将肿瘤抗原 HPV16E7 以基因工程技术呈递至大肠杆菌 OMVs,获得重组 OMVs 疫苗;(2)在巨噬细胞及骨髓来源的 DCs 细胞内进行体外研究,考察重组 OMVs 递送抗原和绿色荧光蛋白的能力;(3)在小鼠 TC-1 移植瘤模型中考察呈递 HPV16E7 的重组 OMVs 激发特异性细胞免疫应答及抑制已建立肿瘤生长的能力。
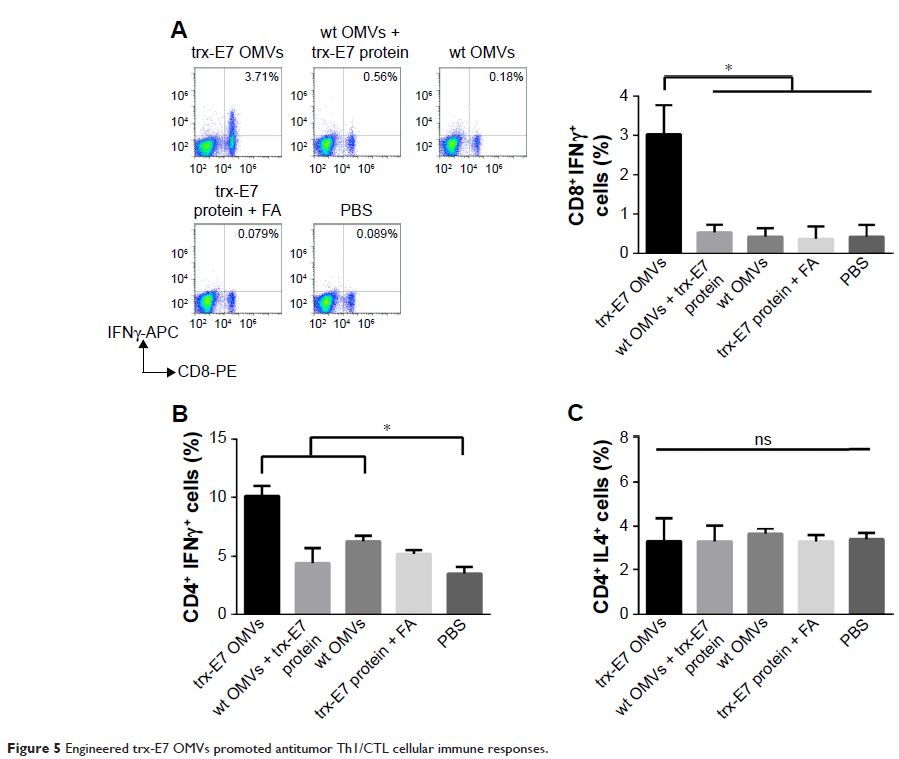
结果:大肠杆菌 DH5α 分泌的 OMVs 能够快速被 DCs 细胞摄取,其囊泡结构在摄取过程中起到重要作用;OMVs 能有效刺激 DC 细胞表达成熟标记 CD80、CD86、CD83 和 CD40;肿瘤抗原 HPV16E7 能够经基因工程技术成功被植入到 OMVs,该重组 OMVs 皮下免疫小鼠能够诱导小鼠产生 E7 特异性细胞免疫应答,具体表现为 ELISPOT 分析证明脾细胞中分泌 IFNγ 的细胞数增加、流式细胞分析证明表达 IFNγ 的 CD4 及 CD8 细胞数增加。此外,经该重组疫苗作用后,较重组 E7 蛋白混合 OMVs 及单独 E7 蛋白免疫均能诱导有效的细胞免疫应答及肿瘤抑制效率。
结论:纳米级 OMVs 具有成为一种有效肿瘤疫苗递送系统的潜力。
关键词:外膜囊泡,树突状细胞,HPV 免疫治疗